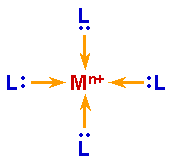
Metallkomplexe entstehen, indem sich mehrere Teilchen mit freien Elektronenpaaren, die Liganden, an ein
Zentralion anlagern. Es werden jeweils koordinative Bindungen ausgebildet.
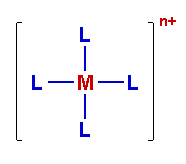
Die Summenformeln von Metallkomplexen werden in eckige Klammern gesetzt. An erster Stelle steht das Zentralion, dann
folgen die Liganden. Handelt es sich beim Liganden um ein Molekül, wird es in (runde) Klammern gesetzt.
Nach der schließenden eckigen Klammer folgt hochgestellt die Ladung.*
| Zentralion + Liganden |
® |
Komplex |
| Mn+
+ 4
:L |
® |
[ML4]n+ |
 |
® |
 |
Die Ladung des Komplexes ergibt sich aus der Ladung des Zentralions und der Summe der Ladungen der Liganden.
Sind die Liganden neutral (wie in obigem Schema), ist die Ladung des Komplexes gleich der Ladung des
Zentralions:
Cu2+ + 4 NH3
® [Cu(NH3)4]2+
Sind vier Liganden beispielsweise einfach negativ geladen, ergibt sich bei einem zweifach
positiv geladenen Kation die Komplex-Ladung -2:
Cu2+ + 4 Cl–
® [CuCl4]2–
* ) Die eckigen Klammern werden hier zur Markierung des Komplexes verwendet, sie bezeichnen in
diesem Zusammenhang keine Konzentrationen.


 BMBF-Leitprojekt Vernetztes Studium - Chemie
BMBF-Leitprojekt Vernetztes Studium - Chemie

